慢病毒使用操作手册
慢病毒安全使用规范
1.1汉尹生物使用的是第三代慢病毒高效率包装系统,具有很高的安全性(将gag, pol和rev基因分到了不同质粒中;去掉了tat transact tivation基因)。
1.2 病毒操作时最好使用生物安全柜,如使用普通超净工作台操作病毒,一定要关闭风机。
1.3 病毒操作时必须穿实验服,带口罩和手套。
1.4操作病毒时必须特别小心,不要产生气雾或飞溅。如果操作时超净工作台有病毒污染,立即用10%次氯酸钠溶液擦拭干净。接触过病毒的枪头,离心管,培养板,培养液于10%次氯酸钠溶液内浸泡1h以上后弃去。
1.5用显微镜观察细胞感染情况时应遵从以下步骤:拧紧培养瓶或盖紧培养板。用70%乙醇清理培养瓶外壁后到显微镜处观察拍照。离开显微镜实验台之前,用70%乙醇清理显微镜实验台。
1.6病毒操作完毕后,脱掉手套,用肥皂和水清洗双手。
慢病毒的储存与稀释
2.1病毒的储存:客户在收到慢病毒液后,如果在很短的时间内就开展实验的话,可以将病毒置于4℃保存;如果长期保存可将病毒装入冻存管中置于-80℃冰箱(注意:病毒可以在-80℃保存6个月,如果超过6个月,建议使用前重新测滴度)。
2.2反复冻融对病毒的滴度是有影响的,每次冻融会使病毒的滴度降低10%左右,所以尽量避免反复冻融,建议分装成小体积的方便每次使用。
2.3病毒的稀释:客户如需稀释病毒,可以先将病毒冰浴融化,再用目的细胞或PBS或无血清培养基稀释混匀后4℃保存,为保证病毒滴度,建议在3天内使用完毕。
慢病毒体外感染实验
3.1感染和分析
瞬时表达:慢病毒感染细胞后,至少要培养24~48小时才能检测目的基因的表达。原因是慢病毒载体的基因组是RNA,需要反转录为DNA,并插入细胞染色体后才能表达。
感染细胞最佳MOI的测定
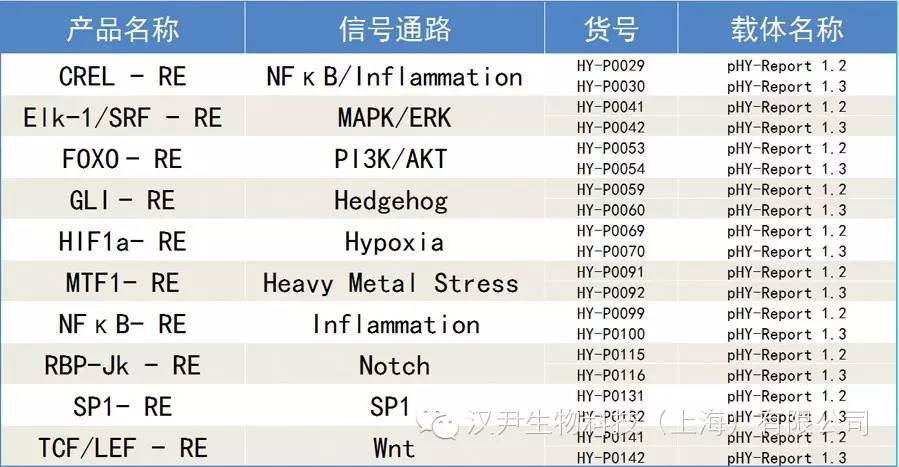
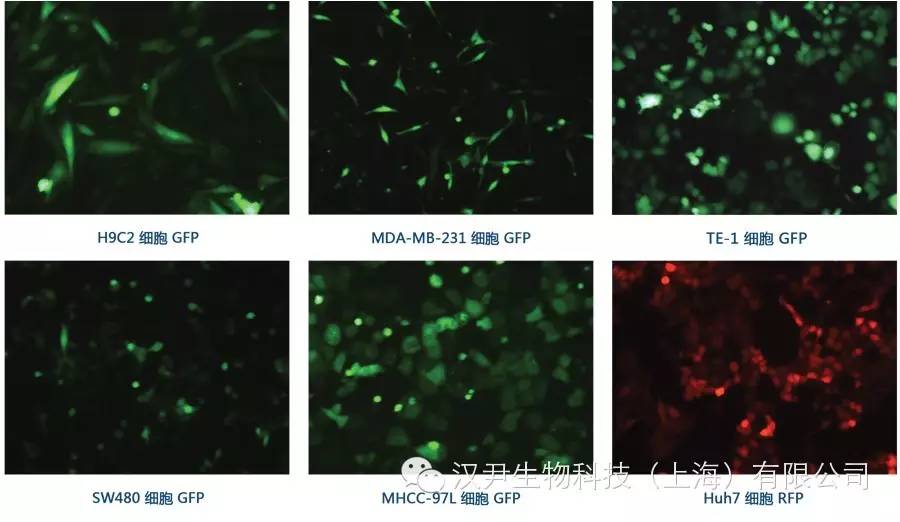
MOI(Multiplicity of Infection,感染复数)是指每个细胞感染的病毒数,通常MOI越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。对于分裂活跃的细胞,比如Hela、293细胞,MOI=1时,80%以上的细胞均表达目的基因。而对于非分裂细胞,比如原代细胞,感染效率较低。我们建议通过比较不同MOI(比如0、1、5、10、50、100等),选择适合的MOI进行实验(可以考虑选用携带报告基因的病毒,比如Lenti-eGFP)。
感染方法
按实验需要将细胞铺板(比如24孔板)。细胞数以第2天密度约50%为宜。37℃培养过夜。
感染前,从-80℃冰箱取出后在冰浴融化病毒,用新鲜完全培养基稀释成所需浓度。注意:轻轻混匀,不要使用振荡器。
吸去细胞原有培养基,将按照MOI稀释好的病毒液加入细胞中。
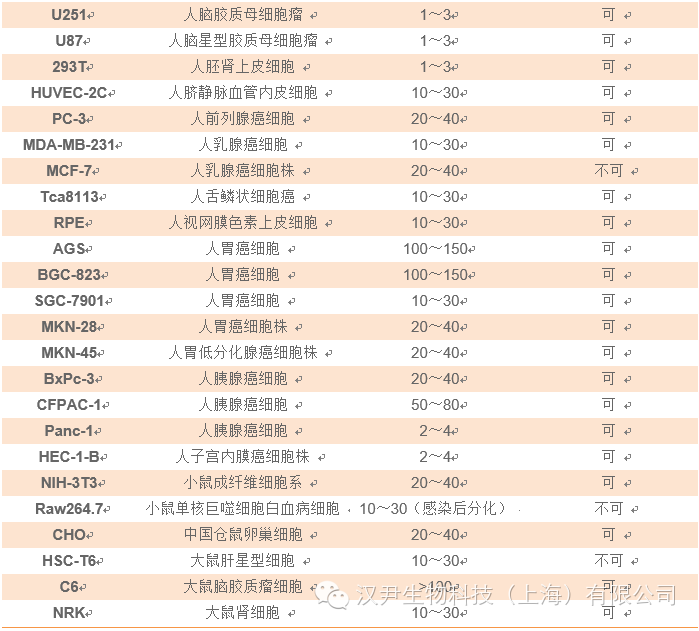
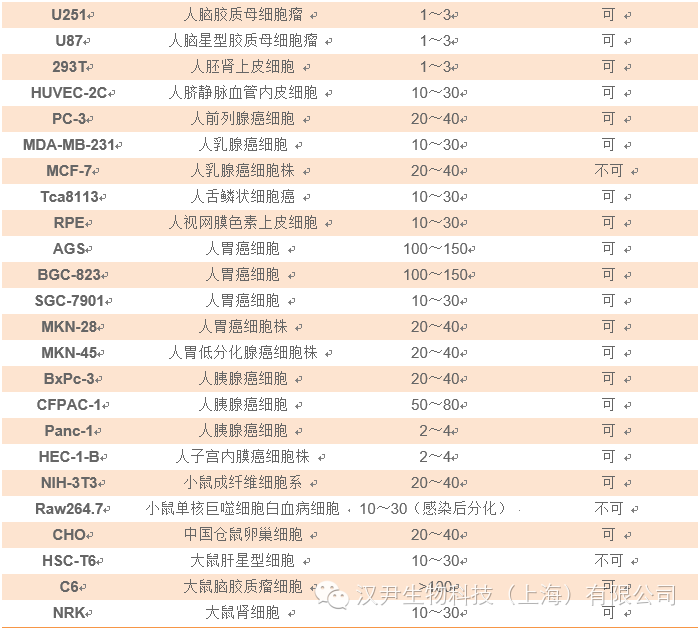
加入Polybrene(对于293细胞,终浓度6μg/ml),轻轻摇匀。37℃培养过夜。注:慢病毒对目的细胞感染效率较低时,可以通过提高MOI值来提高感染效率,但是当MOI高于20时,我们建议客户添加Polybrene(终浓度2~12μg/ml,浓度因不同的细胞而异,具体的请参考相关文献)来提高病毒的感染效率。如果感染目的细胞是Jurkat,kasumi,NB4,H929,GBC-SD,MCF-7等,建议不要添加Polybrene;大部分原代细胞感染也不需要添加Polybrene,以上仅供参考,具体详见附录。
感染24小时后,吸除含慢病毒的培养基,换为新鲜的培养基。
继续培养48~72小时后,根据需要收集细胞检测目的蛋白的表达。